ICH協調Q13指南:藥物生產的未來取決于連續流動
人用藥品技術要求國際協調理事會(ICH)制定了ICH指南,以確保以安全有效的方式開發高質量的藥物。ICH Q13指南出臺,透露監管機構對連續生產的強烈支持。
最近通過的ICH Q13指南描述了實施連續生產(CM)過程的監管考慮因素和科學方法,以及制藥行業中連續生產(CM)的操作和生命周期管理的考慮因素。該信息適用于新藥的CM和現有產品批量生產向CM的轉換。
本指南是一份出色的報告,總結了連續流動的基本概念,并將其與它們對生產設施產品質量的影響聯系起來(從監管角度來看)。結合附件中提供的示例,ICH指南闡明了制藥行業采用CM工藝的監管框架。
任何制造過程都需要一個強大的控制策略,以確保一致的過程性能和產品質量,并確定參數何時漂移以及應采取哪些措施。
連續生產可改善反應控制、一致的產品質量和無縫的實時分析,避免批次之間的質量差異。
控制策略可能是確保過程安全的最重要部分;對于 CM 過程,它考慮以下參數:
· 停留時間分布、混合和分散 – 它們決定了達到穩定狀態所需的時間,這是確保過程穩定和產品質量一致(在啟動和關閉期間很重要)的關鍵。
· 實時分析 – 及時監控溫度、壓力甚至高級分析(如紫外、紅外、拉曼甚至 HPLC 或 NMR)的關鍵
· 如何增加生產“批次”尺寸——這是一個艱巨的批量挑戰,因為它涉及改變反應器尺寸,改變反應器的混合和加熱特性。在連續流中,有以下幾種選擇:
a.使用現有流程運行更長時間
b.線性放大:通過保持恒定的關鍵反應參數,如混合、停留時間和溫度,可以通過增加反應器體積和流速來提高產量
c.橫向擴展,并行運行多個反應器
1、連續生產現狀與監管限制
幾十年來,制藥公司大多依靠批次生產(Batch Production)的方式制造他們的產品。 在批次生產中,“批次”是指通過多步過程生產特定數量的藥物,反應物駐留在特定的反應釜中,并轉化為目標產物或者中間物。雖然批次生產是最傳統和經典的制造方法,但步驟之間的轉移可能緩慢且效率低下。考慮到可持續生產的需求與成本壓力,制造商已開始將連續制造技術應用于藥品生產過程。如果生產涉及多個離散階段(和生產設施)的順序加工和材料測試,那么連續生產將整個制造過程組合成一個單一的、完全集成的流程。
雖然連續生產的實際應用依然有限,但 FDA 以及其它監管機構已經明顯表達了他們支持連續生產的態度。連續生產似乎有望在未來幾年發揮重要作用,因為在過去五年中,連續生產設施的數量翻了兩番。連續生產是一種生產系統,其中被處理的材料連續運動。與批次生產不同,在連續工藝的情況下,原材料被連續送入反應體系,并連續收獲產品,從設備中排出。所有材料連續流過生產系統,消除了不同工藝步驟之間的保持時間(hold time)。隨著生產的進程,連續工藝逐漸進入穩定狀態,在此期間過程參數可以保持穩定狀態。
監管指南的滯后是阻礙連續生產大行其道的一個重要因素。出于對于不同監管機構之間在連續生產政策上的不協調,以及對于可能不得不陷入post-approval 變更的擔憂,加上對監管延遲對于產品上市進程阻礙的擔憂,制造商對連續生產工藝的開發和利用的熱情明顯打了折扣。
2、ICH Q13出臺
近日,國際協調委員會 (ICH) 通過了原料藥和成品藥連續生產的 Q13 指南。該指南擴展了 FDA 藥物評估和研究中心 (CDER) 2019 年 2 月起草的指南草案《連續生產的質量考慮因素》(Quality Considerations for Continuous Manufacturing),并且包括了治療性蛋白質(注:FDA 指南的草案不適用于生物制藥和 API)。這個新的 ICH 指南提供了一個整體且系統的方法,并提供了如何實施和歸檔連續生產流程的具體示例。它還表明全球對連續生產的憧憬,以及表達了對歐洲藥品管理局和 FDA等監管機構同步標準的希望。
新的 ICH Q13 指南希望通過連續生產實現簡化制造過程的優勢。比如減少純化步驟、減少循環時間、降低雜質產生等。該指南還對連續生產的工藝驗證提出了更清晰的路線。
該指南指出,連續生產工藝的潛在優勢包含但不限于以下內容:
改進的工藝控制可為患者帶來利益,包括產品質量的調高和避免供應混亂。
由于可在連續生產中使用更小的設備,且制造過程更簡單,因此生產成本可以得到降低。
輕松放大(scaling)生產過程,以最少的調整和監管付出實現更大的生產規模。
縮短審批時間和整體上市時間。
可實現連續的工藝驗證方法,減少工藝驗證的復雜性和文書負擔。
3、ICH Q13指南:如何實施連續生產
ICH Q13的主體分為五個部分:1. 指南介紹;2. 連續生產概念;3. 科學途徑(包括控制策略、生產產產出變化、連續工藝驗證);4. 監管考慮,5:示例。
3.1 連續生產之定義
對于連續生產的定義,ICH Q13指南列舉了幾種可被視為連續生產的模式:
一些單元操作以批次生產的模式運行,而其他單元操作集成并以連續模式運行
原料藥或成品藥生產過程的所有單元操作被集成并以連續模式運行
原料藥和制劑的單元操作,跨越原料藥和制劑之間的邊界被集成以形成單一的連續過程,也就是說,原料藥通過集成單元操作連續產生,并被連續加工成制劑
3.2 連續生產批次規模定義
ICH Q7 對批次的定義適用于上述所有模式的連續生產,包括原料藥和成藥品。基于此定義,連續生產的批次大小可以根據以下之一的方式定義:
輸出材料的數量
輸入材料的數量
在定義運行時間下的質量流量
以上定義并不排除其它合理的批次大小的定義。例如,可以通過定義最小和最大運行時間來建立批量大小范圍。
3.3 連續生產控制策略 (Control Strategy)
指南列舉了以下方式制定控制策略:
受控狀態(state of control)
受控狀態 (state of control) 是提供持續工藝性能和產品質量保證的先決條件。受控狀態的條件可能會有所不同,具體取決于連續生產的模式和具體的工藝步驟。例如,當一組參數(比如工藝參數和質量屬性)的變化被控制在預先指定的范圍內,可以證明連續生產過程的受控狀態,但工藝不一定處于穩定狀態。
工藝動力學(process dynamics)
工藝動力學知識對于維持連續生產中的受控狀態很重要。具體而言,了解瞬間事件(transient events)的影響,有助于識別材料(中間品和產物)質量風險,并制定適當的控制策略。連續生產操作期間發生的瞬態事件可能是計劃內的(例如過程啟動、關閉和暫停)或計劃外的(例如干擾),并且可以通過時間、過程參數和質量屬性值來描述。
實踐者應表征工藝動力學,以了解瞬態事件如何影響輸出材料質量。 這種表征可以通過確定諸如停留時間分布 (RTD,residence time distribution) 等特性來完成。工藝動力學或 RTD 的變化可能會影響工藝特性,例如原料藥生產中的轉化率,產量和雜質形成。
材料表征和控制(material characterisation and Control)
材料屬性會影響連續生產操作和性能的各個方面,例如材料進料、工藝動態和輸出材料質量。了解材料屬性及其可變性對工藝性能和產品質量的影響,對于控制策略的開發很重要。
設備設計與系統集成 (equipment design and system integration)
設備的設計及其集成,會影響工藝動力學、物料傳輸和轉化、輸出物料質量等眾多方面。在開發連續生產工藝及其控制策略時,重要的是還要考慮集成系統的特性,以及可能影響工藝性能的單個設備。需要考慮的因素包括系統保持集成流、管理連續生產操作中的潛在中斷,以及完成生產內容的能力。此外,為了集成,還應評估傳輸步驟,包括停留時間分布RTD。
工藝監控(process monitoring and control)
工藝監控旨在維持生產過程中的受控狀態,并允許實時評估系統性能。常規批次生產工藝監測和控制的常用方法,包括目標設定值(target setpoints)和控制范圍(control range)的建立、設計空間 (design space) 和質量規格(specification),這一切都仍然適用于連續生產。
過程分析技術 (PAT,Process analytical technology) (ICH Q8) 非常適合連續生產。例如檢測蛋白質濃度的在線 UV flow cells、用于評估混合均勻性或水含量的在線近紅外光譜 (NIR),以及用于監測化學反應轉化的在線 HPLC。使用 PAT 可以實時檢測干擾。因此連續生產很容易實現主動控制(例如前饋或反饋過程控制)的自動化控制。ICH Q8 和 ICH Q11 中描述的控制策略原則適用于連續生產過程。
材料的可追溯性和轉移(material traceability and diversion)
連續生產的特殊性決定了,它可能會在某個連續生產的階段,例如在系統啟動和關閉期間,或者當干擾沒有得到適當管理和緩解時,生產出不合格材料。在生產過程中從產品流中檢測和轉移潛在不合格材料的能力是衡量連續生產的一個重要特征,在制定控制策略時應予以考慮。
工藝建模(process models)
工藝模型可用于開發連續生產工藝,或作為商業生產控制策略的一部分,包括轉移策略。工藝模型也可用于實時預測質量屬性,從而能夠及時調整工藝以保持受控狀態。在開發過程中,工藝模型可以通過關聯輸入和輸出來支持設計空間的建立(這一點與DOE建模理念一致)。工藝模型可以增強工藝理解,并減少實驗研究的數量。
4、監管考慮
指南中的監管注意事項描述了應評估并包含在監管文件中的特定領域:
制造和工藝控制的描述
控制策略
批次描述和批次大小
工藝模型
原料藥和藥物產品的穩定性
監管注意事項部分還包含一個有用的表格,描述了應在通用技術文件 (CTD,common technical document) 提交部分中的信息和數據。此外,指南的這一部分進一步討論了 RTD 和轉移控制,以及如何將這些概念納入監管文件。
5、示例
該指南的最后部分提供了如何開發和實施連續生產工藝的示例。這些連續生產的例子包括:
小分子API
片劑成品藥
蛋白質API
整合原料藥和藥物產品 (圖1)
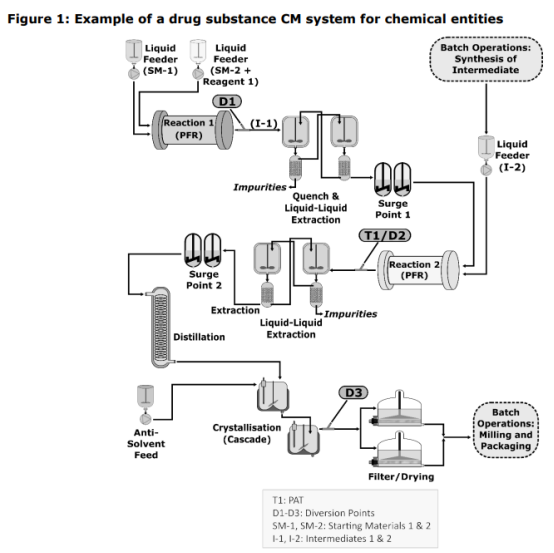
圖1. 集成原料藥和藥品連續生產系統的示例(圖片來源ICH Q13)
6、總結
ICH Q13的出臺強烈顯示了監管部門對于連續生產技術的支持態度,它進一步加強了對連續生產的指導,可以幫助制藥商更好地理解連續生產的途徑。這可能有助于制藥公司接受 FDA 和其他機構的鼓勵,從而增加投入而實現連續生產的切實應用。
然而要實施連續生產所必需的控制,無疑需要對工藝有非常深入的認識和理解。無論從人力還是財力投入的角度,全面鋪開連續生產的實踐恐怕仍然需要一定的時間。希望 Q13 指南和 FDA 的鼓勵將引導一些公司把連續生產的開發列入日程。公司的第一個連續生產工藝可能會花費更長的時間和更多的成本,但從長遠來看,連續生產工藝的開發和利用,無疑將使這些實踐者受益良多。從這個角度看,ICH Q13 指南一定將加速連續生產的實施。
關鍵字: 連續生產 (CM)、藥物開發、質量質量設計、控制策略、工藝模型、GMP、生命周期管理
ICH guideline Q13 on continuous manufacturing of drug substances and drug products - Scientific guideline
MICROFLUTECH所發布的新聞資訊只作為知識提供,僅供各位業內人士參考和交流,不對其精確性及完整性做出保證。您不應以此取代自己的獨立判斷,因此任何信息所生之風險應自行承擔,與MICROFLUTECH無關。如有侵權,請聯系我們刪除!